8. Вторичная профилактика после перенесенного острого ИМпST
Больным, перенесшим ОИМпST, следует вовлекать в программы вторичной профилактики (Рекомендации ЕSC по ведению больных ИМпST, 2012; Рекомендации Американского колледжа кардиологов (ACCF)/AHA по ведению больных с ИМпST, 2013; доказательность: класс I, уровень В).
56
8.1. Курение
Прекращение курения после перенесенного ИМ - потенциально эффективное профилактическое вмешательство. Систематический обзор и мета- анализ 20 когортных исследований показали положительное влияние прекращения курения на снижение летальности среди тех, кто курил (0,64, 95% ДИ 0,58–0,71) в сравнении с продолжающими курить пациентами. При этом, отмечено достаточно быстрое снижение риска смерти уже в течение первых 6 месяцев. Другой мета-анализ когортных исследований показал, что отказ от курения больных после ОИМ ведет к уменьшению сердечно-сосудистой летальности на 50%.
Исследование SAVE (Sleep Apnea Cardiovascular Endpoints), в которое включались больные после ИМ с систолической дисфункцией ЛЖ, продемонстрировало, что отказ от курения был связан со снижением всех случаев смерти (на 40%), смерти от повторного ИМ или частоты госпитализации вследствие СН (на 30%).
Курящие больные с ОИМпST должны быть консультированы и включены в программы по отказу от курения (доказательность: класс I, уровень А). При этом лечебные учреждения, оказывающие помощь больным с ОИМ, должны иметь разработанные протоколы по отказу от курения (доказательность: класс I, уровень С).
Прекращение курения – обязательное условие ведения больных, перенесших ИМ.
Вынужденный отказ от курения в первые дни болезни и в период реконвалесценции создает идеальнее условия для высокой мотивации больного к полному прекращению курения в будущем. Следует привлечь внимание окружения больного, в первую очередь, членов семьи, к этому вопросу, указав, в частности, на вред вторичного курения. Всех тех, кто курит, нужно поощрять бросать курить. Нет никаких возрастных ограничений для прекращения курения. Также должны быть даны рекомендации о вреде пассивного курения и необходимости его избегать.
Прекращение курения – комплексный и трудный процесс, поскольку курение вызывает сильное фармакологическое и психологическое привыкание. Основное направление лечения табакокурения – поддержание установки на отказ от курения, замещение или "компенсация" привычки к курению, выработка отвращения к табаку (психологического или физиологического), снятие никотиновой абстиненции и симптомов табачной интоксикации. Наиболее эффективным предиктором успеха в отказе от курения является мотивация, которая может быть повышена с помощью профессиональной помощи. Рациональная психотерапия выделяет роль самого пациента в деле сохранения и укрепления его здоровья, предоставляя ему активное начало. Критика взглядов, неверных
57
установок должна проводиться деликатно, не провоцируя страх перед болезнью. Даже такая простейшая мера, как разумный совет врача способствует стойкому отказу от курения в 10% случаев. Помимо психологического воздействия на больного, с целью прекращения курения возможно использование заместительной никотинзаместительной терапии, бупропиона и антидепресантов. Имеются доказательства безопасного применения никотиновых пластырей у больных, перенесших ОИМ.
Терапию, способную исключить или максимально снизить симптомы отмены табака целесообразно назначать пациентам с высокой степенью никотиновой зависимости. Для оценки степени никотиновой зависимости обычно используется тест Фагерстрема (Fagerström test) (табл.12).
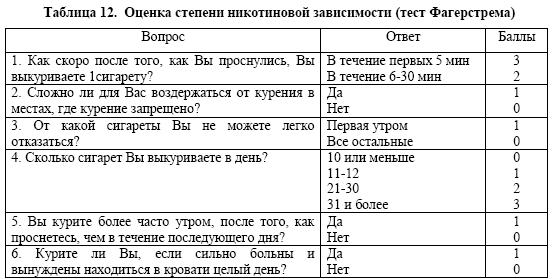
Примечание: Степень никотиновой зависимости определяется по сумме баллов: 0-2 – очень слабая зависимость, 3-4 – слабая зависимость, 5 - средняя зависимость, 6-7 – высокая зависимость, 8-10 – очень высокая зависимость.
Для помощи в отказе от курения эффективны как индивидуальные, так и групповые занятия. Наилучшей поддержкой является совместный отказ от курения нескольких членов семьи. Мероприятия по отказу от курения, проводимые во время пребывания в больнице, должны быть продолжены после выписки для достижения и закрепления успеха.
8.2. Диета
Современная диета, нацеленная на профилактику, в том числе у больных, перенесших ИМ, включает: ограничение калоража пищи, повышенное потребление фруктов и овощей, цельнозерновых злаков и хлеба грубого помола, рыбы (особенно
58
жирных сортов), постного мяса и молочных продуктов с низком содержанием жира, замену насыщенных и транс- жиров на мононенасыщенные и полиненасыщенные жиры растительного и морского происхождения (табл.13).

Поступление общего количества жиров с пищей необходимо уменьшить до 30%, при этом насыщенные жиры должны составлять не более 1/3 от всех жиров. Замена
насыщенных жиров мононенасыщенными жирными кислотами (МНЖК) обеспечивает положительное действие на уровень ХС ЛПВП, а на полиненесыщенные жирные кислоты
(ПНЖК) - снижение уровня ХС ЛНП и в определенной степени повышение уровня ХС ЛВП. Омега-6 ПНЖК содержаться преимущественно в растительной пище, а омега-3
ПНЖК преимущественно в рыбьем жире. Эйкозапентаеновая и докозагексаеновая жирные кислоты (ЖК) – наиболее важные представители группы омега-3 ЖК. В различных
исследованиях при использовании низких доз эйкозапентаеновой и докозагексаеновой ЖК было показано снижение смертности от ИБС. Так, увеличение употребления рыбы до
1–2 раз в неделю может снизить смертность от ИБС на 36% и общую смертность на 17%.
Поэтому рекомендовано употреблять в пищу рыбу не менее двух раз в неделю, в один из приемов должна быть жирная рыба (скумбрия, палтус, сардины, тунец, лосось, сельдь).
Важно ограничить потребление продуктов, содержащих трансизомеры ненасыщенных ЖК, которые образуются при частичной гидрогенизации растительных
59
масел. Трансизомеры ненасыщенных ЖК повышают уровни ХС ЛНП, их потребление не должно превышать 1% от общей калорийности пищевого рациона.
В случае повышенного уровня АД следует ограничить потребление соли. По данным мета-анализа даже непродолжительное сокращение потребления поваренной соли до 1 г/день снижает уровень систолического АД на 3,1 мм рт.ст. у пациентов, страдающих АГ, и на 1,6 мм рт.ст. у лиц с нормальным уровнем АД. Оптимальное потребление поваренной соли ~ 3 г/день.
В последние годы наибольший интерес вызывает Средиземноморская диета (Mediterranean diet), состоящая из большого количества фруктов, овощей, бобовых, цельнозерновых продуктов, рыбы и ненасыщенных ЖК (особенно оливкового масла), умеренного употребления алкоголя (в основном вина, преимущественно с едой) и низкого содержания в рационе питания красного мяса, продуктов быстрого питания и насыщенных жиров. Средиземноморская диета - важный фактор, приводящий к существенному снижению смертности от ССЗ в странах Средиземноморья.
Для оценки приверженности Средиземноморской диете разработана шкала (Mediterranean diet score), в которой каждый пищевой компонент оценивается в один балл, если его доля в рационе питания выше среднего уровня в популяции (фрукты, овощи, бобовые, цельнозерновые продукты, рыба, умеренное потребление вина) или ниже среднего уровня (красное мясо и мясные продукты, продукты быстрого приготовления). В зависимости от количества продуктов, выбранных из выше перечисленного, сумма баллов может быть от 0 до 7–9. В мета-анализе было доказано, что повышение приверженности Средиземноморской диете на каждые 2 балла было связано со снижением сердечно- сосудистой заболеваемости и смертности на 10% (ОР 0,90, 95% ДИ 0,87–0,93) и общей смертности на 8% (ОР 0,92, 95% ДИ 0,90–0,94).
Потребление углеводов может варьировать от 45 до 55% от общей калорийности рациона. Потребление простых углеводов рекомендуется заменить сложными, т.е. использовать продукты, богатые клетчаткой и имеющие низкий гликемический индекс, такие как овощи, бобовые, фрукты, орехи, зерновые злаки.
Пищевые волокна (особенно растворимого типа), присутствующие в бобовых, фруктах, овощах и цельных злаках, оказывают прямое гипохолестеринемическое действие.
Нет оснований для использования после ИМ добавок с антиоксидантами и лечения, направленного на снижение уровня гомоцистеина.
60
Индивидуальную диету больным составляют с учетом коморбидных состояний (СД, болезни почек, желудочно-кишечного тракта и пр.) и осложнений ИБС, в первую очередь наличия СН.
8.3. Контроль массы тела
Ожирение становиться серьезной проблемой у больных с ОИМ. Масса тела считается избыточной при ИМТ от 25 до 29,9 кг/м2, а ожирение диагностируется при ИМТ
≥30 кг/м2.
Предполагается, что региональное распределение жировой ткани имеет большее значение в определении сердечно-сосудистого риска, чем общая масса тела.
Избыточная масса тела и ожирение увеличивают риск смерти при наличии ССЗ, также имеется положительная линейная корреляционная зависимость между ИМТ и уровнем смерти от всех причин. Снижение массы тела рекомендовано у больных с ожирением или окружностью талии >102 см у мужчин и >88 см у женщин (Рекомендации Европейской ассоциации по изучению ожирения (EASO), 2010; доказанность: класс I, уровень А). При избыточной массой тела или окружности талии >94 см у мужчин и >80 см у женщин не следует увеличивать ее и продолжать контроль.
Основные пути нормализации веса – это диета с пониженной калорийностью, физические упражнения и изменение образа жизни. Пациентам ИБС с избыточной массой
тела (ИМТ ≥27 кг/м2) или ожирением, ассоциированными с коморбидными состояниями, рекомендовано назначение медикаментозной терапии.
8.4. Контроль АД
У больных с ОИМпST и сопутствующей АГ уровни АД должны хорошо контролироваться, поскольку риск развития повторных коронарных событий зависит от величины АД. Данные ретроспективного анализа исследования PROVE IT–TIMI 22 (the PRavastatin Or atorVastatin Evaluation and Infection Therapy–Thrombolysis In Myocardial Infarction 22) подтвердили, что после ОКС целевой уровень систолического АД должен быть <140 мм рт.ст., но не ниже 110 мм рт.ст. Следует помнить и о пороговом значении уровня диастолического АД (70-75 мм рт. ст.), при котором дальнейшее снижение АД может сопровождаться ухудшением течения заболевания (Российские Рекомендации по диагностике и лечению АГ, 2013).
Для контроля уровня АД, наряду с общепринятыми немедикаментозными вмешательствами (снижение потребления соли, повышение ФА и нормализация ИМТ), предпочтение отдается антигипертензивным препаратам, необходимым больным после ОИМ и по другим показаниям (БАБ, АПФ или БРА). (Российские рекомендации по
61
диагностике и лечению АГ, 2013; Рекомендации Европейского Общества Гипертонии (ESH)/ESC по лечению АГ, 2013). Если больной уже получает эти средства в рекомендуемых дозах, но целевой уровень АД не достигнут, возможно присоединение других гипотензивных средств. В том случае, если у пациента есть симптомы стенокардии, то предпочтение следует отдавать БАБ и антагонистам кальция (Рекомендации ESH/ESC, 2013; доказанность: класс I, уровень А).
8.5. Гиполипидемическая терапия
Влияние на уровень ХС ЛНП – обязательный компонент терапии больных, перенесших ИМ. Уровень липидов натощак должен определяться у всех больных с ОИМпST как можно раньше (предпочтительно в первые 24 часа) (Рекомендации ACCF/AHA по ведению больных с ОИМпST, 2013; доказанность: класс I, уровень С).
Повторное определение уровня ХС ЛНП следует проводить через 4–6 недель после развития ОИМпST для контроля достижения целевого значения ХС ЛНП≤1,8 ммоль/л или его снижения более чем на 50% (Рекомендации ESC по ведению больных с ОИМпST, 2012; доказанность: класс IIа, уровень С).
Всем больным с ИМпST рекомендовано как можно раньше в период госпитализации назначать статины в высокой дозе независимо от исходного значения ХС ЛНП при отсутствии противопоказаний или истории непереносимости статина (Рекомендации ESC по ведению больных с ОИМпST, 2012; рекомендации ACCF/AHA по ведению больных с ОИМпST, 2013; Рекомендации ACC/AHA по контролю уровня ХС для снижения атеросклеротического кардиоваскулярного риска у взрослых, 2013; доказанность: класс I, уровень А).
Установлено, что терапия статинами пациентов после ОКС, включая ИМпST, снижает риск смерти от ИБС, повторного ИМ, мозгового инсульта и потребность в операции реваскуляризации миокарда. Более интенсивная терапия статинами по сравнению с менее интенсивной терапией связана с дополнительным снижением развития несмертельных клинических событий.
К настоящему времени имеются данные о достоверном снижение смерти и ишемических событий у больных с ОКС на высокой дозе (80 мг в день) аторвастатина (Рекомендации ESC по ведению больных с ОИМпST, 2012; Рекомендации ACCF/AHA по ведению больных с ОИМпST, 2013).
Использование умеренноинтенсивной терапии статином (снижение ХС ЛНП на 30- 50%) может быть рассмотрено только у больных с повышенным риском побочных эффектов (старческий возраст, нарушение функции почек и печени, указания на побочные
62
действия статинов в прошлом и возможность лекарственных взаимодействий с компонентами обязательной терапии) (Рекомендации ACC/AHA по контролю за уровнем ХС для снижения атеросклеротического кардиоваскулярного риска у взрослых, 2013); доказанность: класс I, уровень А.
У пациентов с непереносимостью любой дозы статина можно рассмотреть назначение эзетимиба (Рекомендации ESC по ведению больных с ОИМпST, 2012). Использование других липидснижающих препаратов, включая фибраты и никотиновую кислоту, в том числе в дополнение к статину, у людей, перенесших ИМпST, соответствует общим рекомендациям их применения при атеросклерозе и хронических формах ИБС. Данные о преимуществах раннего назначения других гиполипидемических препаратов (кроме статинов) отсутствуют.
После ИМпST больные должны получать статины, неопределенно долго, если нет противопоказаний. Раннее применение статинов у этих больных должно сочетаться с эффективным изменением образа жизни и рекомендациями по диете.
Подтверждение того, что прием омега-3 ПНЖК у пациентов, перенесших ИМ, снижает смертность получено в одном исследовании GISSI-Prevenzione trial (Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto Miocardico-Prevenzione). Такой эффект омега-3 ПНЖК скорее объясняется их антиаритмическими свойствами. В целом данные об эффектах препаратов, содержащих омега-3 ПНЖК, у больных после ИМ противоречивы и не позволяют рекомендовать их рутинное использование по этому показанию.
8.6. Антиагреганты
8.6.1. Ацетилсалициловая кислота (АСК)
АСК должна назначаться неограниченно долго (>12 мес.) всем больных ИМпST, не имеющих противопоказаний (аллергия, обострение язвенной болезни желудка и 12- перстной кишки, геморрагический диатез) с целью вторичной профилактики. Для длительной поддерживающей терапии рекомендуются дозы от 75 до 100 мг 1 раз/сут (доказанность: класс I, уровень А).
АСК ингибирует циклооксигеназу (ЦОГ-1), блокирует образование тромбоксана А2 и вызывает необратимую блокаду функции тромбоцитов. Прием АСК прекращается только в случае непереносимости или наличия побочных действий, требующих ее отмены.
При непереносимости АСК из-за аллергии может быть предпринята попытка десенсибилизации с последующим длительным приемом АСК. В случае невозможности десенсебилизации или в случае непереносимости АСК вследствие другой причины
63
неаллергического характера, в качестве альтернативы рекомендуется клопидогрел в дозе 75 мг 1 раз/сут (доказанность: класс I, уровень В).
При планируемых хирургических вмешательств, в т.ч. внесердечных, включая полостные операции, отмена АСК нежелательна. Если принимается решение о ее отмене из-за опасения геморрагических осложнений, терапия АСК у больных, перенесших ИМ, должна быть возобновлена как можно скорее и не позднее 24 часов после окончания операции.
8.6.2. Блокаторы P2Y12 рецептора к аденозиндифосфату
В большинстве случаев после выписки из стационара больным с ИМпST рекомендуется продолжить двойную антитромбоцитарную терапию посредством
блокаторов рецептора P2Y12 тромбоцитов (клопидогрел, тикагрелор или прасугрел) в сочетании с низкими дозами АСК (75-100 мг/сут), при отсутствии таких
противопоказаний, как высокий риск кровотечений.
В настоящее время у больных, перенесших ОИМпST, доказана клиническая эффективность применения двойной антиагрегационной терапии клопидогрелем с АСК
при любом методе лечения данного заболевания (после первичной ЧКВ, тромболитической терапии или при отсутствии реперфузионного лечения) (класс
рекомендаций I). Сообщается о том, что примерно у 30% больных, принимающих клопидогрел, не отмечается подавления зависимой от рецепторов P2Y12 функции
тромбоцитов.
Появление препаратов третьей генерации ингибиторов P2Y12 рецепторов - тикагрелора и прасугрела определило новые возможности профилактики атеротромботических осложнений после ОКС.
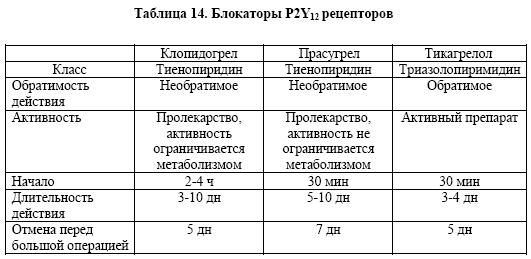
Тиенопиридины - клопидогрел и прасугрел – это пролекарства, которые превращаются в активные молекулы, необратимо связывающиеся с P2Y12 рецепторами
тромбоцитов; тикагрелол – производное пиримидина, которое является активным веществом и для проявления его эффективности не требуется метаболизма в печени
(табл.14). Применение тикагрелола и прасугрела приводит к более быстрому и выраженному подавлению активности с P2Y12 рецепторов тромбоцитов.
64
В исследовании PLATO (PLATelet inhibition and Outcomes) у больных с неинвазивной (консервативной) стратегией лечения ОКС применение тикагрелора по сравнению с клопидогрелем приводило к большему снижению комбинированной точки - сердечно-сосудистой смерти/ИМ/инсультов (12,0% vs 14,3%, р=0,04) и общей смертности (6,10% vs 8,2%, р=0,01). При этом встречаемость всех «больших» кровотечений составила 11,9% на тикагрелоле и 10,3% на клопидогреле (р=0,08). Очевидно, что больным после ОКС, которые не подвергаются ЧКВ, назначение в первые 12 месяцев комбинации тикагрелора с АСК более предпочтительно, чем комбинации клопидогрела с АСК (Рекомендации Американской коллегии торакальных специалистов в (АССР), 2012; доказанность: класс II, уровень В).
Больным с ИМпST, которым выполнено первичное ЧКВ, может рекомендоваться двойная антиагрегационная терапия АСК в сочетании с тикагрелором или прасугрелем (Рекомендации ESC по ведению больных с ОИМпST, 2012; доказанность: класс I, уровень В).
Следует отметить, что прасугрел показан только больным, перенесшим первичное ЧКВ со стентированием в возрасте моложе 75 лет, без инсульта/транзиторной ишемической атаки в анамнезе и не принимавших клопидогрел.
Прием клопидогрела после ЧКВ следует рассматривать у пациентов, которые не могут по какой-либо причине получать тикагрелор или прасугрел (Рекомендации ESC по профилактике ССЗ, 2012; доказанность: класс I, уровень А; Рекомендации ESC по ведению больных с ОИМпST, 2012; доказанность: класс I, уровень С). Поскольку у пациентов с ИМпST, подвергнутых инвазивным вмешательствам, двойная антитромбоцитарная терапия АСК с ингибитором P2Y12 (тикагрелором или прасугрелем) имеет больше преимуществ, чем сочетание АСК с клопидогрелем (Рекомендации АССР, 2012; доказанность: класс II, уровень В).
Поддерживающие дозы ингибиторов P2Y12 рецептора тромбоцитов составляют: клопидогрел 75 мг 1 раз/сут, тикагрелор 90 мг 2 раза/сут, прасугрел 10 мг 1 раз/сут (но при массе тела менее 60 кг доза 5 мг 1 раз в день).
65
Многие рекомендательные документы содержат пожелание использовать двойную антиагрегантную терапию в течение 1 года у всех больных, независимо от выполнения реперфузии и метода, использованного для ее реализации. При стабильном течении болезни у больных с повышенным риском кровотечений возможно сокращение длительности приема двойной антиагрегационной терапии АСК с одним из блокаторов рецептора P2Y12тромбоцитов до 3-6 месяцев.
При использовании голометаллических стентов минимальная длительность одновременного приема двух антиагрегантов может составлять 1 мес. (доказанность: класс I, уровень С). При применении стентов с лекарственным покрытием минимальная длительность приема комбинации двух антиагрегантов составляет 6 мес. (доказанность: класс IIб, уровень B ).
Если больному планируется хирургическое вмешательство, блокатор P2Y12 рецептора тромбоцитов следует отменить за 5-7 суток до предполагаемой операции и возобновить его прием после снижения угрозы послеоперационного кровотечения.
Лабораторное мониторирование активности тромбоцитов для практических целей (подбора дозы или выбора антиагреганта) пока себя не оправдала.
8.7. Антикоагулянты
Один из вариантов ведения больных после ИМпST, независимо от проведения реперфузионного лечения и метода, которым оно выполнено, предусматривает одновременное использование АСК, клопидогрела и антикоагулянта – ингибитора Xа фактора ривароксабана в низкой дозе 2,5 мг 2 раза/сут (но только у больных с низким риском кровотечений) (доказанность: класс IIб, уровень В).
Применение ривароксабана в исследовании ATLAS ACS 2-TIMI 51 (Addition to Standard therapy in subjects with Acute Coronary Syndrome-Thrombolysis in Myocardial Infarction 51) на фоне АСК и клопидогреля привело к дополнительному снижению риска развития комбинированной точки – сердечно-сосудистой смерти/ИМ/инсульта, а также общей смертности и тромбоза стента. Возможность использования для лечения комбинации ривароксабана с тикагрелором или праcугрелом не изучена.
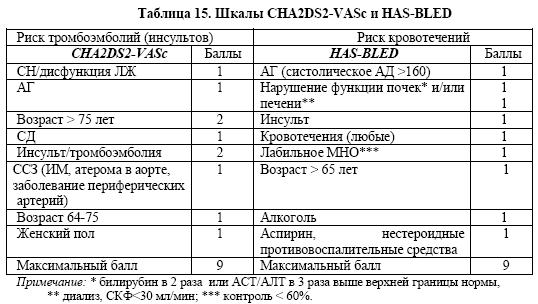
При наличии дополнительных показаний к длительному приему антикоагулянтов, таких как фибрилляция предсердий/трепетание предсердий (по шкале CHA2DS2-VASc ≥2, табл.15), тромбоз полостей сердца, прежде всего ЛЖ, механические и в ряде случаев биологические протезы клапанов сердца, венозные тромбозы или тромбоэмболия легочной артерии (ТЭЛА), следует использовать антагонисты витамина К (варфарин),
66
доза которых должна быть подобрана еще в стационаре (Рекомендации ESC по ведению больных с ОИМпST доказанность: класс I, уровень С).
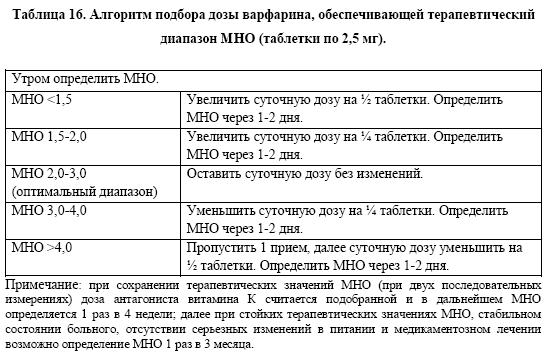
Для продолжения лечения антагонистами витамина К после выписки из стационара обязателен контроль международного нормализованного отношения (МНО) в амбулаторных условиях с целью оценки эффективности терапии и коррекции дозы препарата (табл.16).
67
Длительность применения антагонистов витамина К зависит от показаний и клинической ситуации. Фибрилляция предсердий/трепетание предсердий и наличие протезов клапанов сердца (механических и в ряде случаев биологических) требует пожизненного лечения антикоагулянтом. При наличии тромба в полости ЛЖ, в венах нижних конечностей и при ТЭЛА продолжительность антикоагулянтной терапии должна составлять не менее 3 месяцев и может быть более длительной у больных с низким риском кровотечений (доказанность: класс IIа, уровень В).
Комбинация трех антитромботических препаратов – варфарина (под контролем МНО 2-2,5), АСК (75-100 мг/сут) и клопидогрела (75 мг/сут) – изучена мало, но допускается у больных с показаниями к применению антагонистов витамина К, подвергаемых ЧКВ. Известно, что столь активное антитромботическое лечение сопряжено с высоким риском геморрагических осложнений. Если подобное сочетание лекарственных средств представляется необходимым, например, при стентировании коронарных артерий у больного с фибрилляцией предсердий или другими показаниями к антикоагулянтам, такую терапию следует ограничить короткими сроками (от 1 до 3-6 месяцев в зависимости от типа стента) или конкретной клинической ситуацией (доказанность: класс I, уровень С). В последующем (до 12 месяцев) при низком/среднем риске кровотечений (HAS-BLED 0-2, табл.15) можно продолжить терапию антагонистом витамина К (под контролем МНО 2-2,5) в сочетании с клопидогрелем (75 мг/сут) или АСК (75-100 мг/сут) (доказанность: класс IIб, уровень С).
Применение двойной антиагрегационной терапии посредством АСК и клопидогрела может рассматриваться у больных с ОИМпST и фибрилляцией предсердий при низком риске по шкале CHA2DS2-VASc (≤1).
При сохранении потребности в антикоагулянтах через 1 год после ИМ может использоваться монотерапия (без антиагрегантов) антагонистом витамина К с целевым МНО 2,0-3,0 (если не требуется поддержание более высоких значений при наличии механического протеза клапанов сердца) или осуществлен переход на новые пероральные антикоагулянты - апиксабан или дабигатран (у больных без механических протезов клапанов сердца).
Роль новых антикоагулянтов (апиксабана и дабигатрана) в комбинации с АСК или в комбинации с АСК и ингибитором P2Y12 для вторичной профилактики при ОИМпST остаются дискутабельной.
68
8.8. Бета-адреноблокаторы
Назначение БАБ следует рассматривать у всех больных, перенесших ОИМnST, при отсутствии противопоказаний к их использованию (доказанность: класс I, уровень В). Особенно БАБ рекомендуются больным с дисфункцией ЛЖ или с СН (доказанность: класс I, уровень А).
БАБ улучшают прогноз, уменьшают число госпитализаций, оказывают кардиопротекторное действие, уменьшая степень ремоделирования сердца и замедляя прогрессирование декомпенсации. БАБ также могут назначаться при электрической нестабильности сердца и клинических проявлениях ишемии миокарда.
После выписки из стационара больные продолжают лечение БАБ, подобранное в остром периоде заболевания или начинают его, если ранее оно не использовалось. Больным, перенесшим ОИМnST, БАБ следует принимать неопределенно долго (до 3-х лет) (Рекомендации ACCF/AHA/ACP/AATS/PCNA/SCAI/STS по диагностике и ведению больных со стабильной ИБС, 2012); (доказанность: класс I, уровень В).
Есть основание считать, что благотворное действие БАБ после перенесенного ИМ свойственно большинству препаратов этого класса, за исключением БАБ, обладающих внутренней симпатомиметической активностью. Очевидно, не следует лишать больного лечения БАБ при наличии относительных противопоказаний, таких как СД, периферический атеросклероз и обструктивные заболевания легких, не попытавшись очень осторожно в условиях тщательного контроля оценить их переносимость, начиная с минимальных доз. Предпочтительнее назначать кардиоселективные БАБ, обладающие лучшей переносимостью.
8.9. Блокаторы ренин-ангиотензин-альдостероновой системы (РААС)
8.9.1. иАПФ
После перенесенного ИМпST иАПФ должны применяться неограниченно долго у всех больных, не имеющих противопоказаний к их использованию (доказанность: класс IIа, уровень А). Препараты этой группы особенно эффективны при переднем ИМ,сниженной сократительной функции ЛЖ (ФВ ≤40%), СН (доказанность: класс I, уровень А). Особенно показаны иАПФ больным с АГ, СД, хроническими заболеваниями почек. иАПФ улучшают прогноз и у больных с «низким» риском - без клинически значимого снижения ФВ, при хорошем контроле ФР или после выполненной реваскуляризации (доказанность: класс IIа, уровень В).
У больных, перенесших ОИМ, в долгосрочных исследованиях установлены клинические преимущества таких иАПФ, как каптоприл, рамиприл, трандолаприл,
69
фозиноприл, зофеноприл и периндоприл. Высокая эффективность выше перечисленных иАПФ в снижении смертности, частоты повторных госпитализаций, профилактике развития СН и ее прогрессирования у больных после ОИМ было продемонстрировано в рандомизированных, контролируемых исследованиях: SAVE (Survival And Ventricular Enlargement) TRACE (Trandolapril Cardiac Evaluation), AIRE (Acute Infarction Ramipril Efficacy Trial), SMILE (Survival of Myocardial Infarction Long-Term Evaluation), FAMIS (Fosinopril in Acute Myocardial Infarction Study).
При сравнении разных иАПФ было установлено клиническое преимущество зофеноприла перед лизиноприлом у больных с ОИМ передней стенки и тромболитической терапией в исследовании SMILE-2, а также перед рамиприлом у больных после острого ИМ с систолической дисфункцией ЛЖ в исследовании SMILE_4.
Периндоприл продемонстрировал способность достоверно блокировать процессы постинфарктного ремоделирования ЛЖ, являющегося основным механизмом в предотвращении развития ХСН, у больных после ОИМ в исследовании PRE–AMI (Perindopril and Remodeling in Elderly with Myocardial Infarction Study). Анализ клинической эффективности периндоприла во вторичной профилактике у больных, перенесших ИМ (>3 мес., n=7910), при отсутствии клинических признаков СН в исследовании EUROPA (European trial on Reduction of cardiac events with Perindopril in patients with stable coronary artery disease), подтвердил пользу его назначения (против контроля) для снижения риска развития конечной точки - сердечно-сосудистой смертности/ИМ/остановки сердца (на 22.4%, р<0,001), повторного ИМ (на 27,9%, р=0,001)и СН (47,6%, р<0,001).
Применение иАПФ для профилактики внезапной сердечной смерти у больных после ИМ с дисфункцией ЛЖ или признаками СН отнесено к наивысшему уровню доказанности класс I, уровень А).
Общий принцип лечения иАПФ – это постепенное увеличение (титрование) дозы до рекомендуемой (целевой), которая по данным клинических исследований обеспечивает положительное влияние на прогноз, а если это невозможно, до максимально переносимой дозы препарата.
Результаты выполненных исследований показывают, что при отсутствии противопоказаний лечение иАПФ желательно продолжать неопределенно долго, в т.ч. у больных без значительного снижения сократительной функции ЛЖ. В процессе лечения иАПФ необходимо контролировать содержание креатинина и калия в крови, особенно у больных с нарушенной функцией почек.
70
8.9.2. Блокаторы рецептора ангиотензина II
БРА (валсартан) оказывают примерно такой же клинический эффект, как и иАПФ. Они могут использоваться вместо иАПФ при непереносимости последних. Однако, опыт длительного применения БРА после ИМпST значительно меньше. БРА обычно рекомендуются больным с непереносимостью иАПФ при ФВ ≤40% и/или СН, а также при наличии АГ (доказанность: класс I, уровень В).
К настоящему времени опубликовано два рандомизированных клинических исследования, оценивших клиническую эффективность БРА у больных с ОИМпST. Исследование OPTIMAAL (the Optimal Trial In Myocardial infarction with the Angiotensin II Antagonist Losartan) показало, что лозартан (в дозе 50 мг/сут) не превосходит каптоприл (в дозе 50 мг 3 раза/сут) в снижении общей смертности (18,2% vs 16,4%, р=0,069), но несколько увеличивает риск сердечно-сосудистой смертности (15,3% vs 13,3%, р=0,032) у больных старше 50 лет с подвержденным ИМ и симптомами СН.
В противоположность этому, в крупном международном исследовании VALIANT (the VALsartan In Acute myocardial iNfarction Trial) валсартан (160 мг 2 раза в день) в сравнении с каптоприлом (50 мг 3 раза в день) показал аналогичное снижение смертности при лучшей переносимости. Таким образом, из класса БРА только валсартан является эффективным средством профилактики ХСН и альтернативой иАПФ у больных после ИМ, у которых имеются клинические признаки СН и/или снижена ФВ ЛЖ (≤40%), особенно при непереносимости иАПФ.
8.9.3. Блокаторы рецептора альдостерона.
У больных, перенесших ИМ, с ФВ ≤40% в сочетании с симптомами СН или СД без почечной недостаточности к лечению рекомендуется добавить высокоселективный эплеренон (доказанность: класс I, уровень В). Обязательным условием для начала лечения является уровень креатинина в крови у мужчин <2,5 мг/дл (220 мкмоль/л), у женщин <2,0 мг/дл (177 мкмоль/л), а также концентрация калия не более 5 ммоль/л. Начальная доза препаратов составляет 25 мг 1 раз/сут, при хорошей переносимости с последующим увеличением дозы до 50 мг 1 раз/сут (при отсутствии гиперкалиемии).
Назначение эплеренона в крупном рандомизированном исследовании EPHESUS (Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival) больным с ОИМ и дисфункцией ЛЖ (ФВ ЛЖ <40 %) на фоне оптимальной медикаментозной терапии сопровождалось снижением общей смертности (на 15%, р=0,008), сердечно-сосудистой смертности (ССС, на 17%, р=0,005), внезапной смерти (на 21%, р=0,03), числа первичных (на 15%, р=0,03) и повторных (на 23%, р=0,002) госпитализаций вследствие СН.
71
В настоящее время имеются данные о целесообразности приема блокаторов рецептора альдостерона после ОИМ до 2-х лет. При использовании данной группы препаратов важно контролировать уровень калия крови.
8.10. Антагонисты кальция
Мета-анализ 28 рандомизированных исследований (n=19 000), включавших больных с ИМnST, не показал положительного влияния антагонистов кальция, назначаемых как в острый период болезни, так и в период реконвалесценции, на снижение риска ССО.
Имеющиеся сообщения о возможности верапамила у больных с ИМ без признаков СН снижать общую смертность, сердечно-сосудистую смертность и внезапную смерть (в исследовании Danish Study Group on Verapamil in Myоcardial Infarction) позволяют рассматривать возможность его использования для вторичной профилактики после перенесенного ИМ в случае наличия абсолютных противопоказаний к приему БАБ и при отсутствии СН (доказанность: класс IIб, уровень В).
Рутинное применение антагонистов кальция дигидропиридинового ряда у больных, перенесших ОИМ как в период реконвалесценции, так и в период дальнейшего наблюдения, очевидно, следует ограничить наличием АГ и стенокардии.
8.11. Органические нитраты
У больных после ОИМnST как в период реконвалесценции, так и в дальнейшем нет показаний для рутинного применения пролонгированных нитратов. Назначение пролонгированных нитратов может быть приемлемым для контроля симптомом стенокардии в качестве терапии второй линии (Рекомендации ESC по ведению больных стабильной стенокардией, 2013; доказанность: класс IIа, уровень В).
8.12. Метаболические миокардиальные цитопротекторы
Метаболический миокардиальный цитопротектор - триметазидин (пролонгированного высвобождения) ингибирует 3-кетоацил-КоА-тиолазу в митохондриях, что приводит к переключению основного пути образования энергии в клетке с бета-окисления ЖК на более эффективное аэробное окисление глюкозы.
В исследованиях показано, что триметазидин способен устранять (уменьшать) ишемию миокарда на ранних стадиях ее развития и тем самым предотвращать возникновение ее более поздних проявлений – стенокардии, снижения сократительной способности миокарда.
72
Триметазидин (35 мг 2 раза/день) может быть рассмотрен для назначения в качестве препарата второй линии контроля стенокардии (доказанность: класс IIб, уровень В). Антиишемическое действие триметазидина при его добавлении к терапии БАБ превосходит таковой эффект комбинации пролонгированных нитратов с антагонистами кальция (Согласованное мнение российских экспертов, 2012). При этом выраженность положительного эффекта триметазидина возрастает по мере увеличения продолжительности лечения.
Имеются данные положительного влияния триметазидина пролонгированного высвобождения после перенесенного ИМ на снижение смертности, предупреждение появления ССО (в том числе повторных ИМ, реваскуляризации и госпитализации) и улучшения качество жизни (Согласованное мнение российских экспертов, 2012; Рекомендации ACCF/AHA/ACP/AATS/ PCNA/SCAI/STS по диагностике и ведению больных со стабильной ИБС, 2012; Рекомендации ESC по ведению больных со стабильной стенокардией, 2013).
В двух рандомизированных клинических исследованиях у больных, перенесших ИМ, триметазидин в сравнении с обычной программой ФТ повышал ФРС, максимальное потребление О2, ФВ ЛЖ и улучшал перфузию миокарда по данным изотопной сцинтиграфии миокарда, т.е. оказывал такой эффект как и программа ФТ (Методические рекомендации по реабилитации больных ИБС, 2003).
8.13. Контроль гликемии и лечение СД
У больных с ОИМпST тщательный контроль за уровнем гликемии крови улучшает прогноз заболевания. Поэтому у больного, перенесшего ОИМ, еще до выписки из стационара следует составить организационный план для мониторирования уровня глюкозы крови (Рекомендации ESC по ведению больных с ОИМпST, 2012; доказанность: класс I, уровень С). После выписки из стационара больным целесообразно провести тест для определения толерантности к глюкозе, в первую очередь, у больных с гипергликемией, но без истории СД (доказанность: класс IIа, уровень В).
Активность специфической гипогликемической терапии основывается на определении HbA1c, который, согласно действующим рекомендациям эндокринологов, должен быть в пределах ≤7,0% у большинства больных СД обоих типов, но с оговоркой учета индивидуальных особенностей пациента (Рекомендации EASD/ESC по диабету, предиабету и сердечно-сосудистых заболеваниям, 2013; доказанность: класс I, уровень А). Глюкоза натощак должна быть ниже 7,2 ммоль/л, а постпрандиальная - ниже 9-10 ммоль/л. При этом рекомендуется достигать целых уровней глюкозы с учетом
73
индивидуальных особенностей больных: длительности СД, наличия коморбидности и возраста больного (доказанность: класс I, уровень С).
Успешная сахароснижающая терапия требует самостоятельного контроля глюкозы крови, особенно при инсулинзависимом СД. Контролировать HbA1c следует ежеквартально, если он находится вне целевых значений, и один раз в 6 месяцев, если он близок к целевому уровню.
Выбор средств контроля гликемии индивидуален и диктуется, прежде всего, соображениями безопасности: предпочтение отдается средствам, не вызывающим гипогликемии и не ухудшающим течение СН. Подробная информация о сахароснижающих препаратах представлена в Рекомендациях EASD/ESC по диабету, предиабету и сердечно-сосудистых заболеваниям, 2013.
В последние годы появилась информация о возможном негативном влиянии на прогноз больных интенсивной терапии, сопряженной с повышенным риском развития гипогликемии, и это следует учитывать при назначении терапии.
Учитывая известное негативное влияние препаратов сульфонилмочевины на риск ишемических событий, следует использовать их только в случае неэффективности других гипогликемических средств. Инсулин, меглитины и сульфонилмочевина частично ассоциированы с гипогликемией при СД обоих типов. Тем не менее, эффекты нормализации гликемии в отношении развития ССО остаются недостаточно изученными, а завершившиеся в последние годы клинические исследования не предоставили исчерпывающей информации для прояснения этого вопроса.
При лечении больных с ОИМ, имеющих СД, следует помнить об положительных эффектах БАБ: улучшении прогноза, снижения вероятности реинфаркта, внезапной смерти или желудочковых аритмий. Показано, что общий позитивный эффект БАБ на прогноз больных СД, перенесших ОИМ, превышает их отрицательные глюкометаболические эффекты. У больных с ИМ наличие СД является дополнительным показанием для применения иАПФ, БРА (валсартана) и блокаторов рецепторов альдостерона (эплеренона).
8.14. Другое медикаментозное лечение
У больных, получающих двойную антитромбоцитарную терапию или сочетание антиагрегантов с антикоагулянтом, имеется повышенный риск желудочно-кишечного кровотечения, особенно у больных с историей желудочно-кишечного кровотечения или язвенной болезнью. Это является основанием для рассмотрения возможности длительного
74
использования ингибиторов протонного насоса (Рекомендации ESC, 2012; (доказанность: класс I, уровень А).
У больного, которому планируется длительный прием антиагрегантов и антикоагулянтов, следует учитывать факторы, увеличивающие риск желудочно-кишечных кровотечений: возраст, прием гормональных препаратов, нестероидных противовоспалительных средств, инфицирование Helicobacter pylori.
75
У больного, которому планируется длительный прием антиагрегантов и антикоагулянтов, следует учитывать факторы, увеличивающие риск желудочно-кишечных кровотечений: возраст, прием гормональных препаратов, нестероидных противовоспалительных средств, инфицирование Helicobacter pylori.
76
Перейти к началу и оглавлению «Российские клинические рекомендации 2014»
Перейти к разделу «1. Введение.»
Перейти к разделу «3. Практические методы поэтапной кардиореабилитации.»
Перейти к разделу «4. Физическая реабилитация, перенесших острый ИМпST.»
Перейти к разделу «6. Психологическая (психосоциальная) реабилитация при остром ИМпST.»
Перейти к разделу «7. Восстановление сексуальной активности после перенесенного ИМпST.»
Перейти к разделу «8. Вторичная профилактика после перенесенного острого ИМпST.»
Перейти к разделу «9. Приложения - комплексы лечебной гимнастики и схемы физических тренировок.»
Перейти к разделу «10. Список основной литературы.»




